12月1至3日,在2023年欧洲肿瘤内科学会亚洲年会(ESMO Asia)上,齐鲁制药以壁报情势陈述了1类新药艾帕洛利单抗(QL1604)单药医治不成切除或转移性dMMR/MSI-H实体瘤的单臂、II期要害临床研究最新成果。首要研究者为复旦年夜学从属肿瘤病院郭伟剑传授和四川年夜学华西病院毕锋传授。
艾帕洛利单抗是一种与PD-1连系的高选择性人源化单克隆抗体。研究成果显示,艾帕洛利单抗单药医治不成切除或转移性dMMR/MSI-H实体瘤具有杰出的疗效,自力影象评估委员会(IRRC)评估的全人群客不雅减缓率(ORR)为45.8%(95%CI, 36.7-55.2),跨越预设首要研究终点。
1、研究布景
DNA错配修复缺点(dMMR)或高度微卫星不不变(MSI-H)是实体瘤的怪异表型[1]。DNA复制进程中,微卫星序列最易产生错配,需要进行错配修复,dMMR可致使移码突变,引发微卫星不不变(MSI)。dMMR/MSI-H实体瘤对免疫查抄点按捺剂医治反映杰出,法式性灭亡受体-1(PD-1)或法式性灭亡配体-1(PD-L1)按捺剂医治dMMR/MSI-H实体瘤具有较高的客不雅减缓率(ORR),而且减缓延续时候长[2-3]。
艾帕洛利单抗医治晚期实体瘤的I期研究表示出杰出的平安性和抗肿瘤活性,在接管艾帕洛利单抗0.3-3 mg/kg Q3W的所有患者中,ORR到达20%[4]。本要害研究旨在评估艾帕洛利单抗单药医治不成切除或转移性dMMR/MSI-H实体瘤的疗效和平安性。
2、研究设计和方式
本研究为单臂、II期要害临床研究,纳入不成切除或转移性经组织病理学或细胞学确认的dMMR/MSI-H实体瘤患者,接管艾帕洛利单抗单药医治,给药方案为200mg固定剂量(假如受试者体重<40kg,给药剂量为3mg/kg),静脉滴注,每3周给药1次。患者接管艾帕洛利单抗医治直至疾病进展、呈现不成耐受的毒性、最先新的抗肿瘤医治、灭亡、撤回知情赞成等缘由,最长医治时候不跨越2年。医治竣事后,对患者进行保存随访。研究的首要终点为IRRC按照实体肿瘤疗效评价尺度(1.1版)评估的ORR。研究设计以下图所示。

3、研究成果
从2020年6月至2023年1月,研究共纳入120例dMMR/MSI-H实体瘤患者,此中结直肠癌患者80例(66.7%),胃癌患者18例(15.0%),其它实体瘤患者22例(18.3%);97.5%的患者在入组时疾病分期为IV期,中位医治线数为2.0(规模,0–6)。
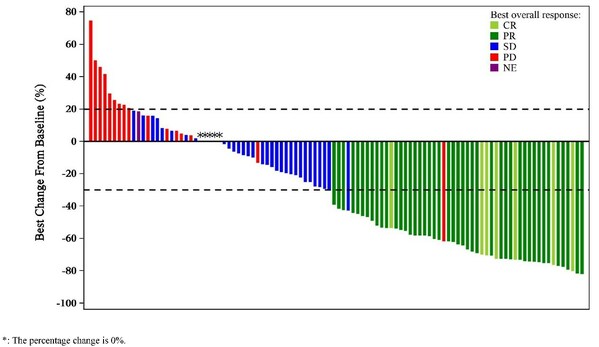
在疗效方面,截至2023年7月20日,中位随访时候为13.6个月,有11例患者到达完全减缓(CR),44例患者到达部门减缓(PR),ORR为45.8%(95% CI: 36.7%–55.2%),疾病节制率(DCR)为77.5%(95% CI: 69.0%–84.6%)。在结直肠癌患者中,ORR和DCR别离为42.5%(95% CI: 31.5%–54.1%)和77.5%(95% CI: 31.5%–54.1%)。中位减缓延续时候(DoR)还没有到达,6个月和12个月DoR率别离为100%和97.4%;中位无进展保存期(PFS)和中位总保存期(OS)未到达。减缓患者的靶病灶最好转变环境以下图所示。
4、小结
艾帕洛利单抗单药医治不成切除或转移性dMMR/MSI-H实体瘤具有杰出的疗效和平安性。齐鲁制药艾帕洛利单抗上市申请已在本年9月取得CDE受理。
参考文献:
1. Bhamidipati D, Subbiah V. Tumor-agnostic drug development in dMMR/MSI-H solid tumors. Trends Cancer. 2023;9(10):828-839.
2. Le DT, et al. PD-1 Blockade in Tumors with Mismatch-Repair Deficiency. N Engl J Med. 2015;372(26):2509-20.
3. Li J, et al. Subcutaneous envafolimab monotherapy in patients with advanced defective mismatch repair/江南体育microsatellite instability high solid tumors. J Hematol Oncol. 2021;14(1):95.
4. Huang Z, et al. A first-in-human, open-label, dose-escalation and dose-expansion phase I study to evaluate the safety, tolerability, pharmacokinetics/pharmacodynamics, and antitumor activity of QL1604, a humanized anti-PD-1 mAb, in patients with advanced or metastatic solid tumors. Front Immunol. 2023;14:1258573.
责任编纂:赵硕